
Ավելցուկ երկաթը խրոնիկ հիվանդությունների ռիսկի նշանակալի գործոն և հանրային առողջապահության մարտահրավեր-3
Գոհար Ջրբաշյան
Երկաթի դերը հիվանդությունների զարգացման մեջ
Երկաթը մարդկանց և միկրոօրգանիզմների թթվածնի տրանսպորտի և մետաբոլիկ ուղիների կարևորագույն սնուցիչ է: Ի լրումն, երկաթն առանցքային դեր է խաղում մարդու իմունային գործառույթում՝ խթանելով լիմֆոցիտների ակտիվացումը և տարածումը: Մյուս կողմից, երկաթի ավելցուկը կարող է ունենալ իմունային համակարգը թուլացնող ազդեցություն: Պաթոգեն միկրոօրգանիզմները, այդ թվում բակտերիաները և սնկերը, երկաթի կարիք ունեն աճելու և բազմանալու համար: Որպես պաշտպանական ռազմավարություն, այլընկալները (օրգանիզմները, որտեղ հաստատվել են մակաբույծները, hosts) մշակել են բազմաթիվ մեխանիզմներ պաթոգեններից երկաթի մատչելիությունը նվազեցնելու համար և երկաթը թաքցնում են հյուսվածքներում: Սրա միջոցով երկաթը դառնում է քիչ հասանելի բակտերիաներին, վիրուսներին, սնկերին, պարազիտներին, և քաղցկեղի բջիջներին, որոնց բոլորի գոյատևման համար երկաթ է պետք: Երկաթի հավելումները և/կամ երկաթով հարստացված սնունդը պարզապես սնուցում են առողջությունը քայքայողներին, այսպիսով հավերժացնելով առողջական խնդիրը՝ դարձնելով այն խրոնիկ: Առողջ մարդու մոտ երկաթի հոմեոստազի համար կարևոր է, որ երկաթի կարգավիճակը պահպանվի մի մակարդակի վրա, որը չի հասցնում անեմիայի և թույլ է տալիս օպտիմալ իմունային արձագանք առանց հեշտացնելու երկաթի հասանելիությունը ախտածին միկրոօրգանիզմների համար (53):
Մարդու մարմնում երկաթը (Fe) հանդիպում է օքսիդացման երկու վիճակում Fe2+ (Fe II, ferrous) և Fe3+ (Fe III, ferric) ձևերով: Երկաթը հեշտորեն ընդունում և տալիս է էլեկտրոններ, ձևափոխվելով ավելի լուծելի Fe2+ ձևից չլուծվող օքսիդացած Fe3+ ձևի և հակառակը, որի արդյունքում երկաթը կարող է խթանել ռեակտիվ թթվածնի տեսակների (ՌԹՏ, reactive oxygen species - ROS) և ռեակտիվ ազոտի տեսակների (ՌՆՏ, reactive nitrogen species - RNS) առաջացմանը՝ օքսիդավերականգնման ռեակցիաների միջոցով: Ֆենտոնի (Fenton) և Հաբեր-Վեյսի (Haber-Weiss) ռեակցիաները H2O2-ի և Fe2+ միջև առաջացնում են խիստ վնասաբեր հիդրոքսիլ ռադիկալներ, որոնք նպաստում են օքսիդային սթրեսին: ՌԹՏ պարադոքսալ ազդեցություն ունեն բջիջների վրա՝ նրանք կարող են նպաստել բջիջների աճին և գոյատևմանը կամ դրդել բջջային մահ: ՌԹՏ որոշ օպտիմալ քանակությունն օգնում է ոչնչացնել բակտերիաներին և վերացնել քաղցկեղի նոր առաջացած բջիջները: Այնինչ, մեծ խտության ՌԹՏ երկարատև ազդեցությունը կարող է գերազանցել բջջի հակաօքսիդանտ պաշտպանությունը և վնասել ԴՆԹ-ն, լիպիդները և սպիտակուցները: Երկաթի հոմեոստազի խաթարումը կապված է պրոգրեսիվ բորբոքային հիվանդությունների, դեգեներատիվ հիվանդությունների, և քաղցկեղի առաջացման հետ: Քանի որ երկաթը նպաստում է վնասակար ՌԹՏ և ՌՆՏ առաջացմանը, ապա երկաթի քանակի փոփոխությամբ հնարավոր է հասնել բորբոքման վիճակի փոփոխության: Բորբոքային հիվանդությունների ժամանակ երկաթի նորմալ մակարդակ ունեցողների մոտ նկատվում է շիճուկի երկաթի անբնական կրճատում՝ հանգեցնելով բորբոքման անեմիայի (սա օրգանիզմի բնական պաշտպանական մեխանիզմն է, որով նվազում է երկաթի հասանելիությունը պաթոգեններին): Այնպես, որ երկաթի խելացիան (երկաթի նվազեցում դեղերով, Chelation) կարող է օգտագործվել որպես բորբոքային հիվանդությունների պոտենցիալ հակաօքսիդատիվ ռազմավարություն: Գծանկար 4-ը ներկայացնում է երկաթի անբավարարության և երկաթի ավելցուկի դերը հիվանդությունների զարգացման մեջ (54):
Գծանկար 4. Երկաթի դերը հիվանդությունների զարգացման մեջ
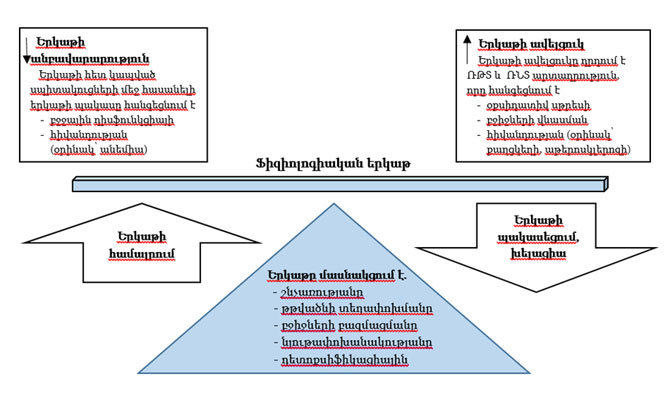
Աղբյուր. Lehmann C, Islam S, et al. The utility of iron chelators in the management of inflammatory disorders. Mediators Inflamm.
Figure 1. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC4386698/figure/fig1/
«Երկաթի վատ վարքագծը: երկաթի ոչ պատշաճ խելացիան որպես անոթային և այլ առաջընթաց (progressive) բորբոքային և դեգեներատիվ հիվանդությունների առաջացմանը նպաստող ազդեցիկ գործոն» երկաթ ներառող ֆիզիոլոգիական գործընթացներին վերաբերող 2469 գիտական հոդվածների ամփոփում է՝ տպագրված BioMedCentral Medical Genomics ամսագրում 2009թ.: Հոդվածում, մասնավորաբար, ներկայացվում են որոշ հիվանդություններ, որոնցում երկաթը կարող է ներգրավված լինել. Ալցհեյմերի, Պարկինսոնի և այլ նեյրոդեգեներատիվ հիվանդություններ, պրե-էկլամպսիա, դիաբետ, նյութափոխանակության համախտանիշ, ճարպակալում, հիպերտոնիա, արտանոթային հիվանդություններ, սրտային անբավարարություն, աթերոսկլերոզ, կաթված, ծերացում, ոսկրերի բեկունություն; ռևմատոիդ արթրիտ, լուպուս (համակարգային կարմիր գայլախտ), ասթմա, աղիքների բորբոքային հիվանդություններ, պսորիազ, ալկոհոլային և լյարդի այլ հիվանդություններ, խրոնիկ օբստրուկտիվ թոքային խանգարում և թոքերի հարակից հիվանդություններ, քաղցկեղ և ուռուցքներ, սեպսիս, և այլն (55):
Մարմնի զանգվածի ինդեքսն ու շիճուկի ֆերրիտինի մակարդակը, և բնածին արատները
«Սնուցիչներ» (Nutrients) ամսագրում 2013թ. լույս տեսած «Երկաթը, մարդու աճը, և ճարպակալման համաշխարհային համաճարակը» հոդվածը ներկայացնում է. Հետազոտությունները հաստատում են մեծ քանակությամբ երկաթ ստացած մարդկանց քաշի հավելյալ աճը: Գիրության ցուցանիշները դրական առնչությամբ են կապված երկաթի մակարդակի հետ։ Մարմնի զանգվածի ինդեքսը (ՄԶԻ, body mass index - BMI) և մարմնի ճարպի այլ ցուցանիշերը կապված են շիճուկի ֆերրիտինի մակարդակի հետ: Մասնավորաբար, նշվում է օտար երկրներում ծնված ԱՄՆ ներգաղթյալների ավել քաշի ու ճարպակալման տարածվածության և երկրում ապրելու տևողության նշանակալի առնչություն (երկաթով հարստացված սննդի և սննդային հավելումների շատ օգտագործման հետևանքով): ՄԶԻ աճը դրական է կապված շիճուկի ֆերրիտինի մակարդակի հետ, ինչը վկայում է երկաթի մատչելիության բարձրացման «նպաստավոր» ազդեցությունը քաշի աճի վրա։ Գիրության հետ առնչվող հիվանդությունների մեծ արագությամբ աճող տարածումն արտացոլում է երկաթի գեր-առատությունը սննդի հարստացում իրականացնող երկրներում (56):
Ըստ «Մանկաբուժություն» (Pediatrics) «Մայրական գիրությունը և բնածին արատների ռիսկը» (2003թ.) հոդվածի՝ նորմալ քաշի կանանց համեմատ, գեր (ՄԶԻ≥30) կանանց նյարդային խողովակի spina bifida արատով երեխա ունենալու հավանականությունը մեծ է 3,5 անգամ, omphalocele` 3,3, սրտի արատ` 2,0, և բազմակի անոմալիաներ՝ 2,0 անգամ։ Նորմալ քաշի կանանց համեմատ, ավել քաշով (25≤ՄԶԻ<30) կանանց երեխաները 2 անգամ ավելի հավանական է, որ սրտի արատ և 1,9 անգամ ավելի հավանական է, որ բազմակի անոմալիաներ ունենան։ Մայրական գիրության (ներառյալ նախքան հղիությունը) և ծննդյան բազմաթիվ արատների բացահայտված կապը հուշում է, որ անհրաժեշտ է ջանքեր գործադրել գիրության կանխարգելման համար, որպեսզի կանայք ունենան առողջ քաշ մինչև հղիությունը և հղիության ընթացքում (57): Համանման արդյունքներ գրանցվել են նաև «Մոր ավել քաշի ու գիրության և բնածին արատների ռիսկը․ համակարգված վերլուծությամբ և մետա-անալիզով (JAMA, 2009թ.)։ Ի համեմատ նորմալ ՄԶԻ ունեցող մայրերի՝ գեր մայրերի մոտ նյարդային խողովակի արատներով հղիությունների ռիսկը 1,87, spina bifida՝ 2,24, սրտանոթային անոմալիաներ՝ 1,3, սեպտալ անկանոնություններ՝ 1,20, գայլի երախ՝ 1,23, շրթունքի և քիմքի ճեղքվածք` 1,20, anorectal atresia` 1,48, hydrocephalus` 1,68, և վերջույթների անոմալիաների ռիսկը` 1,34 անգամ ավելի բարձր է եղել (58):
«Գիրության միջազգային ամսագրի» (International Journal of Obesity) «Մայրական մարմնի զանգվածի ինդեքսը և բնածին արատների ռիսկը» (2010թ.) հոդվածի ներկայացմամբ՝ Անգլիայում իրականացված այս ուսումնասիրության ընթացքում (41013 հղիություն) գրանցվել է 166 կառուցվածքային բնածին անոմալիա 10000 ծնունդների հաշվով։ Պարզվել է, որ բնածին արատների ընդհանուր ռիսկը (ներառյալ ՆԽԱ) մեծ է ճարպակալում (ՄԶԻ≥30) և թերի քաշ (ՄԶԻ≤18,5) ունեցող կանանց երեխաների մոտ: Բնածին արատները 1,6 (1,3) անգամ ավելի շատ են եղել թերքաշ (գեր) կանանց երեխաների մոտ՝ ի համեմատ նորմալ քաշի կանանց։ Մայրական գիրությունը կապված է եղել փորոքային արատի (ventricular septal defect)՝ 1,56, շրթունքի ճեղքվածքի՝ 3,71, աչքի անոմալիաների՝ 11,36 անգամ բարձր ռիսկի հետ։ Մայրական թերի քաշը կապված է եղել նախասրտի արատի (atrial septal defect) 2,86, սեռական օրգանների անոմալիաների՝ 6,30, և հիպոսպադիաների (hypospadias)` 8,77 անգամ զգալիորեն աճած ռիսկերի հետ։ Կանայք պետք է տեղեկացված լինեն այս ռիսկերի մասին և պետք է օպտիմալացնեն իրենց քաշը մինչ հղիությունը և պահպանեն առողջ քաշ հղիության ընթացքում (59):
Երկաթը և վարակիչ ու բորբոքային հիվանդությունները
Երկաթը և նրա հոմեոստազը սերտորեն կապված են բորբոքային արձագանքի հետ: Բորբոքման դեպքում երկաթի դուրս բերումը արյան շրջանառության համակարգից բնածին իմունային պատասխանի մասն է: Դեռևս 1946թ. տպագրված այս աշխատանքները ներկայացնում են. Բորբոքման և վարակի ընթացքում «հիպոֆերրեմիկ արձագանք» (երկաթի անբավարարության արձագանք, hypoferremic response) է նկատվում` բորբոքման անեմիա, քանի որ արյան մեջ առկա երկաթի մի զգալի մասը հայտնվում է հյուսվածքներում: Պարզվում է, որ բորբոքային հյուսվածքն ունի առանձնահատուկ կապակցություն երկաթի հետ: Ցույց է տրվել, և՛ հյուսվածքները ներկելով և՛ քիմիական անալիզով, որ հիվանդներին տրված երկաթը կուտակվում և ամրագրվում է բորբոքային հյուսվածքում և թոքերի տուբերկուլոզային շրջաններում: Աճում է հյուսվածքների երկաթը, բայց ոչ հեմոգլոբինը: Եվ, չնայած, որոշակի առումներով վարակի անեմիան նման է երկաթ-դեֆիցիտի անեմիային, սակայն այն չի արձագանքում երկաթի թերապիային: Երկաթի վերահասցեավորումը հանգեցնում է նրան, որ ձախողվում է հեմոգլոբինի սինթեզը՝ արյան մեջ բավարար քանակով երկաթի բացակայության պատճառով: Եթե վարակն անհապաղ բուժվի, շիճուկի երկաթը կարող է արագ վերադառնալ նորմայի, և անեմիա չզարգանա: Հիպոֆերրեմիան շարունակվում է քանի դեռ վարակը կա (60, 61, 62):
«Սնուցման տարեկան տեսություն» (Annual Review of Nutrition) ամսագրում 2010թ. լույս տեսած «Երկաթի հոմեոստազը և բորբոքային վիճակի պատասխանը» հոդվածը ներկայացնում է. Կլինիկական ապացույցների մեծ քանակություն ցուցադրում է վարակիչ և բորբոքային հիվանդությունների զգայունության և պատասխանի վատթարացում ի հետևանք երկաթի պաշարների ավելացման: Երկաթի ավելցուկի ու վարակիչ հիվանդությունների առնչությունները լավ փաստագրված են: Տուբերկուլոզի համար ցույց է տրված, որ երկաթի ավելացումը հանգեցնում է միկոբակտերիաների աճի, և որ երկաթի հավելումներ ստացողների մոտ աճում է հիվանդացությունն ու մահացությունը: Ի դեպ, սննդային երկաթը կապված է տուբերկուլոզի դեպքերի և դրա պատճառով մահվան հետ: Մալարիան վարակիչ հիվանդության երկրորդ օրինակն է, որը խիստ ենթակա է այլընկալի (host) երկաթի կարգավիճակի ներգործությանը: Ժառանգական հեմոքրոմատոզի հետ կապված երկաթի ավելցուկը նպաստում է վարակիչ պաթոգենների, ինչպես օրինակ Yersinia enterocolitica և Vibrio vulnificus, դյուրընկալությանը: Վարակները շատ տարածված են արյան հաճախակի փոխներարկումով դրդված երկաթի ավելցուկ ունեցող թալասեմիայով հիվանդների մոտ: Երկաթի կարգավիճակը խստորեն ազդում է վիրուսային վարակների ընթացքի վրա: Մինչ երկաթի անբավարարությունը հարաբերական դիմադրություն է շնորհում վարակների նկատմամբ, երկաթի բարձր կարգավիճակը խթանում է հիվանդագին վիճակը: Տեսակետ կա, որ երկաթի պակասությունը կարող է լինել պաշտպանիչ հարմարվողական արձագանք վարակիչ հիվանդությունների ավելի մեծ բեռ ունեցող տարածաշրջաններում (ինչպես օրինակ մալարիայի տարածման շրջաններում): Երկաթի կարգավիճակը խորապես ազդում է նաև խրոնիկական բորբոքային հիվանդությունների վրա: Երկաթի աճած պաշարները փոխկապակցված են խրոնիկ բորբոքման մարկերների և շաքարախտի, ճարպակալման, և մետաբոլիկ սինդրոմի այլ լավ սահմանված ռիսկի գործոնների հետ: Աթերոսկլերոզը, նեյրոդեգեներացիան և լյարդի խրոնիկ հիվանդությունը հաճախ կապված են երկաթի ավելցուկի հետ: Ապացույցների այս աճող քանակությունը նշանակալի է ոչ միայն ժամանակակից հասարակությունում խրոնիկ հիվանդությունների տարածվածության գնահատման համար, այլև նրա համար, որ սննդային երկաթի տեսակի կամ երկաթի կարգավիճակի փոփոխումը կարող է պարզ կանխարգելիչ կամ բուժական հնարավորություն ընձեռել: Օրինակ, դիաբետիկների մոտ բարելավում է գրանցվել ֆլեբոտոմիայի կամ խելացիայի միջոցով երկաթի նվազեցման շնորհիվ՝ առաջարկելով հիվանդությունների վարման նոր մոտեցումներ: Հարկ է նշել, որ երկաթի խելացիան և ֆլեբոտոմիան կիրառվում են նաև քաղցկեղի թերապիայում (63):
ՄԻԱՎ վարակը հաճախ կապված է Mycobacterium tuberculosis վարակի ակտիվացման հետ, և երկաթը կարևոր սնուցիչ է այդ բակտերիաների համար, ինչը համահունչ է այն դիտարկմանը, որ երկաթի կուտակումը կապված է տուբերկուլոզի ռիսկի աճի և ՄԻԱՎ վարակի կլինիկական բացասական ընթացքի հետ: Ըստ այդմ, թաքնված տուբերկուլոզ և թուլացած իմունիտետ ունեցողներին (օրինակ, ՄԻԱՎ վարակի պատճառով) երկաթի հավելումներ և երկաթվ հարստացված սնունդ ընդունելը վտանգավոր է: Հետաքրքրական է, որ երկաթի և՛ անբավարարությունը և՛ կուտակումը կապված են ՄԻԱՎ թե՛ դրական թե՛ բացասական անձանց տուբերկուլոզի կլինիկական բացասական ընթացքի հետ: Սա կարող է իմունային համակարգի վրա երկաթի տարամետ ազդեցությունների հետևանքով լինել: Մի կողմից երկաթն անհրաժեշտ է իմունային բջիջների տարածման և տարբերակման համար և այն գործում է որպես կատալիզատոր հակա-մանրէային ռադիկալների առաջացման համար, իսկ մյուս կողմից (օպտիմալ քանակներից շատ լինելու դեպքում), այն ճնշում է բնածին իմունային գործառույթները և նպաստում է մանրէների տարածմանը: Այսպիսով, երկաթի որոշակի հավասարակշռություն է անհրաժեշտ, ոչ շատ պակաս և ոչ շատ ավել երկաթ, որպեսզի վարակների դեմ հաջողությամբ պայքարելու համար ամրապնդվի իմունային պատասխանը (64):
Երկաթը և սրտանոթային հիվանդությունների ռիսկը
Երկաթի ընդունման, ինչպես նաև մարմնի երկաթի պաշարների ու սրտի իշեմիկ հիվանդության (ՍԻՀ) կապը եղել է տաք քննարկումների առարկա, իսկ համաճարակաբանական արդյունքները հակասական: Այդ կապի քանակական գնահատականը տալու համար կատարվել է կոհորտային ուսումնասիրությունների տվյալների մետա-անալիզ՝ հիմք ընդունելով մինչև 2013թ. հունիսը PubMed-ի շտեմարաններում առկա գրախոսվող ամսագրերում հրատարակված աշխատանքները: Մետա-անալիզն ընդգրկել է 21 ուսումնասիրություն (32 կոհորտ), որոնք ներառում էին 292454 մասնակից` միջինը 10,2 տարի տևող հետագա վերահսկողությամբ (follow-up): Պարզվել է, որ ՍԻՀ դեպքերի հետ հեմային երկաթը դրականորեն է կապված։ Հեմային երկաթի առավելագույն մակարդակ ունեցող խմբի ՍԻՀ ունենալու ռիսկը 57%-ով բարձր է հեմային երկաթի նվազագույն մակարդակ ունեցող խմբի ՍԻՀ ունենալու ռիսկից (RR: 1,57; 95% CI: 1,28 - 1,94) (65):
Իրանի 2 նահանգում գնահատվել է ալյուրին 30մգ/կգ երկաթի սուլֆատ (ferrous sulfate) հարստացման ազդեցությունը 40-65տ. ոչ-անեմիկ տղամարդկանց օքսիդացման սթրեսի բիոմարկերների և երկաթի կարգավիճակի վրա: Հերթական ստուգումը ցույց է տվել, որ շիճուկի երկաթի մակարդակն էապես աճել է ելակետային 102,9±31,5մկգ/դլ-ից է 117,2±29,8մկգ/դլ-ի: Միջին ընդհանուր հակաօքսիդանտ հզորությունը (1,71±0,10մկմ) զգալիորեն ավելի ցածր էր, քան ելակետային արժեքը (1,83±0,17մկմ): Ստացված տվյալները չեն աջակցում ալյուրի 30մգ/կգ երկաթի սուլֆատով հարստացման անվտանգությունը որպես ոչ-անեմիկ առողջ տղամարդկանց երկաթի անբավարարությունը վերահսկելու միջոց (66, 67):
Հեռանկարային 6 ուսումնասիրությունների (որոնք ընդհանուր առմամբ ներառում են 131553 մասնակից՝ 2459 սրտի իշեմիկ հիվանդությունով) համակցված արդյունքները ցույց են տալիս, որ հեմային երկաթ ամենա շատ ընդունած մասնակիցների ՍԻՀ ունենալու ռիսկը 31%-ով բարձր է ի համեմատ հեմային երկաթ ամենաքիչ ընդունածների (RR = 1,31, 95% CI: 1,04-1,67): Ճապոնացիների տվյալները բացառելու դեպքում (դիտարկելով միայն արևմտյան բնակչությունները) RR եղել է 1,46 (95% CI: 1,21-1,76): Օրական լրացուցիչ 1մգ հեմային երկաթ ընդունելու չափաբաժին-արձագանքը (dose-response) եղել է 1,27 (95% CI: 1,10-1,47): Այսինքն, յուրաքանչյուր հավելյալ 1մգ հեմային երկաթ ընդունելն ավելացնում է ՍԻՀ ռիսկը 27%-ով: Այս լայնածավալ մետա-անալիզը վկայում է, որ հեմային երկաթի ընդունումը կապված է սրտի իշեմիկ հիվանդության ռիսկի աճի հետ (68):
«Սնուցում, նյութափոխանակություն, և սրտանոթային հիվանդություններ» (Nutrition, Metabolism, and CardioVaascular Diseases) ամսագրում 2015թ․ լույս տեսած «Հեմային երկաթի ընդունումը և սրտանոթային հիվանդության ռիսկը: չափաբաժին-արձագանքի մետա-անալիզ հեռանկարային կոհորտային ուսումնասիրությունների հիման վրա» հոդվածը նշում է. Համարվում է, որ երկաթը կարևոր դեր է կատարում սրտանոթային հիվանդության (ՍԱՀ) զարգացման մեջ: Այս մետա-անալիզի նպատակն է եղել պարզել չափաբաժին-արձագանք առնչությունը սննդային (այդ թվում հեմային և ոչ հեմային) երկաթի ընդունման և ՍԱՀ ռիսկի միջև: Տասներեք հոդվածների տվյալների այս համակարգված վերլուծությունը ներառել է 252164 մասնակից՝ 15040 ՍԱՀ դեպքով: Հեմային երկաթի ընդունման հետ զգալիորեն աճել է սրտանոթային հիվանդության ռիսկը, և համակցված հարաբերական ռիսկի աճը կազմել է 1,07 յուրաքանչյուր հավելյալ 1մգ/օր հեմային երկաթի համար: Ենթախմբի վերլուծությունները ցույց են տվել, որ հեմային երկաթի ընդունման այդ կապն ավելի ուժեղ էր ոչ մահացու դեպքերի (RR=1,19; 95% CI: 1,07-1,33), և առանձնապես, ամերիկյան հիվանդների (RR=1,31; 95% CI: 1,11-1,56) համար: Այս արդյունքները կարող են կարևոր հանրային առողջապահական հետևանքներ ունենալ սրտանոթային հիվանդության կանխման համար՝ հեմային երկաթով հարուստ սննդի օրական սպառումը նվազեցնելուն ուղղված ուղեցույցների մշակման և ներդրման միջոցով՝ նշում են հեղինակները (69):
Երկաթը և քաղցկեղները
«Ազատ» երկաթը բավականին ցիտոտոքսիկ (cytotoxic) է, ինչպես նաև մուտացիաներ առաջացնող (mutagenic) և դրդում է քաղցկեղ (carcinogenic) (70): Երկաթ պարունակող միացությունները պաշտպանում են ուռուցքի բջիջները ազոտի օքսիդով (NO) միջնորդված աճի արգելակումից ու ապոպտոզից, այսպիսով նպաստելով ուռուցքի բջիջների կենսունակությանն ու աճին (71): Այսպիսով, բացի լայնորեն հայտնի երկաթով դրդված օքսիդատիվ սթրեսից, կան այլ մեխանիզմներ ևս, որոնցով երկաթը նպաստում է քաղցկեղի զարգացմանը:
Կենսական կարևորության միկրոտարր երկաթը մասնակցում է օրգաններին ու հյուսվածքներին թթվածնի մատակարարման և արյունաստեղծման գործընթացներին՝ նպաստելով բջիջների բազմացմանը և աճին: Սակայն, երկաթը նաև օքսիդավերականգնման ռեակցիաների ակտիվ ագենտ է: Օրինակ, Ֆենտոն (Fenton) ռեակցիան, որի ժամանակ երկվալենտ երկաթը (Fe2+) ջրածնի պերօքսիդի (H2O2) հետ ռեակցիայի մեջ մտնելով էլեկտրոն է կորցնում (վերածվելով եռավալենտ երկաթի - Fe3+) և արդյունքում արտադրվում է հիդրոքսիլային ռադիկալ՝ ռեակտիվ թթվածնի տեսակ (reactive oxygen species - ROS): Այս ռեակցիան ոչ միայն վնասում է լիպիդները և սպիտակուցները, այլև առաջացնում է օքսիդատիվ սթրես և վնասում է ԴՆԹ-ն, ներառյալ ԴՆԹ բազային փոփոխություններ և երկու շղթաների խզումներ, որոնք կարող են մուտացիաներ առաջացնել: Հետևաբար, երկաթը և՛ կենսականորեն կարևոր է և՛ պոտենցիալ թունավոր էլեմենտ է: Այնպես, որ երկաթը կարող է նպաստել ինչպես ուռուցքների առաջացմանը, այնպես էլ աճին: Ցույց է տրվել, որ երկաթը դերակատարություն ունի նաև ուռուցքների միկրոմիջավայրի և մետաստազների առաջացման մեջ: Երկաթը կարող է արագացնել ուռուցքի առաջացումը խթանելով ազատ ռադիկալների առաջացումը, ինչպես նաև գործել որպես սնուցիչ, նպաստելով ուռուցքի բջիջների շատացմանը և տարածմանը: Տասնամյակների տևողությամբ գիտական վիճաբանությունը թե ի՞նչ մեխանիզմներով է դա տեղի ունենում կարծես թե վերջապես իր հստակ պատասխանը ստանում է: Համաճարակաբանական և մոլեկուլային ապացույցների հիման վրա հստականում է ավելցուկ երկաթի և երկաթի մետաբոլիզմի խախտումների կապը քաղցկեղի առաջացման հետ: Երկաթի և քաղցկեղի առնչությունների լուսաբանմանը մեծապես նպաստել են երկաթի նյութափոխանակությանը և վերահսկողությանը մասնակցող նոր սպիտակուցների վերջերս արված բացահայտումները, որոնք հնարավորություն են տալիս հասկանալ թե ինչպես են ուռուցքի բջիջները վերածրագրավորում երկաթի նյութափոխանակությունը: Պարզվել է, որ այդ սպիտակուցները կարող են լինել բազմաֆունկցիոնալ և կարող են նպաստել նորագոյացության չարորակացմանը այնպիսի ձևերով, որոնք կապ չունեն երկաթի նյութափոխանակության իրենց առաջնային դերի հետ: Վերջին ուսումնասիրությունները ոչ միայն խոր ընկալում են տալիս երկաթի բջջային և համակարգային նյութափոխանակության մասին, բացատրում և վերասահմանում են երկաթի և քաղցկեղի առնչությունները, այլև կարող են տրամադրել նոր գործիքներ քաղցկեղի թերապիայի համար (72): Torti &Torti այս հոդվածում բերված ամփոփ աղյուսակը ներկայացնում է քաղցկեղի որոշ տեսակներ, որոնց մեջ երկաթը ներգրավված է՝ թոքերի ոչ փոքր բջիջների (Non-small-cell lung cancer), կրծքագեղձի (Breast cancer), երիկամա-բջջային կարցինոմա (Renal cell carcinoma), լյարդի (Hepatocellular cancer), կերակրափողի և ստամոքսի (Oesophageal, stomach), շնչա-կերակրափողի և ստամոքսի լորձաթաղանթի (aerodigestive and gastric cancer), կոլոռեկալ (Colorectal cancer), շագանակագեղձի (Prostate cancer), հեմատոլոգիական քաղցկեղներ` լեյկեմիա, լիմֆոմաներ, միելոմա (Haematological cancers: leukaemias, lymphomas and myeloma), մելանոմա (Melanoma), ենթաստամոքսային գեղձի (Pancreatic cancer), միզապարկի (Bladder cancer) (73):
Այս ուսումնասիրությունն անդրադարձել է այն հարցին թե արդյո՞ք մարմնի բարձր երկաթը մեծացնում է քաղցկեղի առաջացման և մահվան ռիսկը, և որոշել չափաբաժին-արձագանք (dose–response) առնչությունը: Հետազոտությունում ներգրավվել են 3287 տղամադ և 5269 կին, որոնք մասնակցել են ԱՄՆ «Առողջության և սնուցման փորձաքննության ազգային 1-ին հետազոտությանը» (National Health and Nutrition Examination Survey – NHANES I) և անցել էին տրանսֆերինի հագեցվածության հետազոտություն ծրագրում ընդգրկվելու ժամանակ (1971-1975թթ.), ովքեր մնացել են ողջ և առանց քաղցկեղի առնվազն 4 տարի, և եղել են վերահսկողության տակ մինչև 1988թ.: Ուսումնասիրության ընթացքում քաղցկեղ ստացած 379 տղամարդու մոտ ելակետային միջին տրանսֆերին հագեցվածությունը եղել է 32,1%, իսկ քաղցկեղ չունեցողների (2908 հոգի) շրջանում՝ 30,7%: Տղամարդիկ և կանայք բաժանվել են 5 խմբի ելակետային տրանսֆերին հագեցվածության (ՏՀ) հիման վրա՝ 0-30%, 30-40%, 40-50%, 50-60%, և 60% ու ավելի բարձր: Տղամարդկանց 19%-ի ելակետային տրանսֆերին հագեցվածությունը բարձր է եղել 40%-ից, մինչդեռ կանանց միայն 10%-ի մոտ է 40%-ից բարձր եղել այն: Կանանց և տղամարդկանց համատեղ առաջին խմբի համեմատ յուրաքանչյուր խմբում քաղցկեղի առաջացման համակցված ռիսկը եղել է՝ 1,0; 0,95; 1,16; 1,38 և 1,81; մահացության հարաբերական ռիսկերը՝ 1,0; 0,96; 1,22; 1,29 և 1,73: Այսպիսով, ՏՀ>40% քաղցկեղի ռիսկն աճում է երկաթի մակարդակի աճի հետ (74): «Առողջության և սնուցման փորձաքննության ազգային 2-րդ հետազոտությունը» (NHANES II) ևս բացահայտել է, որ շիճուկում երկաթի և տրանսֆերինի հագեցվածության ավելի բարձր մակարդակներ ունեցողերի քաղցկեղից մեռնելու հավանականությունն ավելի մեծ է (75):
Հեմային երկաթի և կոլոռեկտալ քաղցկեղի առնչություններն ուսումնասիրող 8 հեռանկարային հետազոտությունների մետա-անալիզով պարզվել է RR=1,14 (95% CI: 1,04-1,24): Այսինքն, հեմային երկաթ առավելագույն ընդունածների մոտ կոլոռեկտալ քաղցկեղի ռիսկը 14%-ով բարձր է նվազագույն քանակով հեմային երկաթ ընդունածների համեմատ։ Հեմային երկաթի ընդունման չափաբաժին-արձագանք ամփոփ ցուցանիշը եղել է 1,11 (95% CI: 1,03-1,18) 1մգ/օր հեմային երկաթի համար: Այսինքն, յուրաքանչյուր հավելյալ 1մգ/օր ավելացնում է կոլոռեկտալ քաղցկեղի ռիսկը 11%-ով: Այս մետա-անալիզը վկայում է հեմային երկաթի ընդունման կապը կոլոռեկտալ քաղցկեղի հետ՝ զգալի դրական չափաբաժին-արձագանք առնչությամբ (76):
«Կլինիկական սնուցման ամերիկյան անսագրում» (American Journal of Clinical Nutrition) 2012թ․ տպագրված այս ուսումնասիրությունն անդրադարձել է ցինկի և հեմային երկաթի ընդունման և կոլոռեկտալ քաղցկեղի ռիսկի առնչությանը ճապոնական բնակչության մոտ: Այդ նպատակով իրականացվել է լայնածավալ հեռանկարային ուսումնասիրություն, որն ընդգրկել է 45-74 տարեկան 39721 տղամարդ և 45376 կին: Ճապոնական բնակչության սննդային ցինկի և հեմային երկաթի քիչ սպառումը, և դրանց սննդային աղբյուրների տարբերությունը ի համեմատ արևմտյան բնակչության, վկայում են, որ սննդային ցինկի և հեմային երկաթի ընդունումը ճապոնացիների մոտ կապված չեն կոլոռեկտալ քաղցկեղի հետ (77): Արևմտյան բնակչության համեմատ, ճապոնացիներն ավելի քիչ կարմիր միս, և շատ ծովամթերք, ձկան ու թռչնի միս են օգտագործում։
Երկաթը տարբեր տեսակի քաղցկեղների ռիսկի գործոն է հիմնականում իր պրո-օքսիդանտ գործունեության պատճառով, որը կարող է հանգեցնել ԴՆԹ օքսիդատիվ վնասի: Բացի այդ, հայտնի է, որ հեմաքրոմատոզ կամ երկաթի ավելցուկ ունեցողների մոտ ավելի բարձր է լյարդի քաղցկեղի ռիսկը: Սույն մետա-անալիզ և համակարգված վերլուծությունը ներառում է 1995-2012թթ. ընթացքում հրատարակած 59 համաճարակաբանական ուսումնասիրություն: Տվյալների մետա-անալիզը ցույց է տալիս հարաբերական ռիսկը (RR) կոլոռեկտալ քաղցկեղի համար 1,08 (95% CI: 1,00-1,17), հաստ աղիքի (RR = 1,12; 95% CI: 1,03-1,22), կրծքագեղձի (RR = 1,03; 95% CI: 0,97-1,09), և թոքերի քաղցկեղի (RR = 1,12; 95% CI: 0,98-1,29) յուրաքանչյուր հավելյալ 1մգ/օր հեմային երկաթի ընդունման համար: Ընդհանուր առմամբ, ցույց է տրվել, որ հեմային երկաթի ավելի շատ ընդունումը զգալի կապված է քաղցկեղի ռիսկի հետ (78):
 Տեսանյութեր
Տեսանյութեր Լուսանկարներ
Լուսանկարներ
Մեկնաբանել